Kekhasan Atom Karbon
Atom karbon mempunyai nomor atom 6, sehingga dalam sistem periodik terletak pada golongan IVA dan periode 2. Keadaan tersebut membuat atom karbon mempunyai beberapa keistimewaan sebagai berikut.
1. Atom Karbon Memiliki 4 Elektron Valensi
Berdasarkan konfigurasi keenam elektron yang dimiliki atom karbon didapatkan bahwa elektron valensi yang dimilikinya adalah 4. Untuk mencapai kestabilan, atom ini masih membutuhkan 4 elektron lagi dengan cara berikatan kovalen. Tidak ada unsur dari golongan lain yang dapat membentuk ikatan kovalen sebanyak 4 buah dengan aturan oktet.
2. Atom Unsur Karbon Relatif Kecil
Ditinjau dari konfigurasi elektronnya, dapat diketahui bahwa atom karbon terletak pada periode 2, yang berarti atom ini mempunyai 2 kulit atom, sehingga jari-jari atomnya relatif kecil. Hal ini menyebabkan ikatan kovalen yang dibentuk relatif kuat dan dapat membentuk ikatan kovalen rangkap.
3. Atom Karbon Dapat Membentuk Rantai Karbon
Keadaan atom karbon yang demikian menyebabkan atom karbon dapat membentuk rantai karbon yang sangat panjang dengan ikatan kovalen, baik ikatan kovalen tunggal, rangkap 2, maupun rangkap 3. Selain itu dapat pula membentuk rantai lingkar (siklik).
CH3 – CH2 – CH2 – CH2 – CH2 – CH3 CH2 = CH – CH2 – CH3 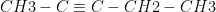 Ikatan kovalen tunggal Ikatan kovalen rangkap 2 Ikatan kovalen rangkap 3
Ikatan kovalen tunggal Ikatan kovalen rangkap 2 Ikatan kovalen rangkap 3 Ikatan Kovalen rantai lingkar (siklik) 4. Atom Karbon memiliki perbedaan kedudukan dalam suatu rantai karbon
Ikatan Kovalen rantai lingkar (siklik) 4. Atom Karbon memiliki perbedaan kedudukan dalam suatu rantai karbon
 Ikatan Kovalen rantai lingkar (siklik) 4. Atom Karbon memiliki perbedaan kedudukan dalam suatu rantai karbon
Ikatan Kovalen rantai lingkar (siklik) 4. Atom Karbon memiliki perbedaan kedudukan dalam suatu rantai karbon- Atom C primer : atom C yang mengikat langsung 1 atom C yang lain
- Atom C sekunder : atom C yang mengikat langsung 2 atom C yang lain
- Atom C tersier : atom C yang mengikat langsung 3 atom C yang lain
- Atom C kuarterner : atom C yang mengikat langsung 4 atom C yang lain
Apa saja Kekahasan Atom Karbon?
Kalau ditanya apa sih yang paling khas dari atom karbon? Jawabannya adalah atom karbon is the only one (satu-satunya) atom yang dapat membentuk rantai ikatan antar sesama atom karbon yang sangat panjang. Atom karbon dapat membagi rata keempat elektron valensinya dalam satu ikatan kovalen yang stabil. Ia memiliki jumlah elektron valensi yang sama dengan jumlah elektron yang dibutuhkan agar mencapai kestabilan sesuai kaidah oktet.
Atom karbon punya ukuran yang relatif kecil dengan jumlah kulit hanya dua (K dan L) sehingga elektron valensi relatif dekat dengan inti atom. Gaya tarik inti atom terhadap elektron valensi cukup kuat. Hal ini menyebabkan atom karbon mudah membentuk ikatan rangkap dengan sesamanya hingga menghasilkan rantai karbon yang bisa sangat panjang. Rantai panjang karbon ini bissa berikatan dengan atom-atom lain membentuk senyawa organik yang sangat kompleks seperti karbohidrat atau vitamin. Kalau ditanya berapa panjangnya rantai karbon yang bisa dibentuk? Jawabannya bisa tak terhingga. Kekhasan atom karbon ini dapat menghasilkan molekul berantai dengan berbagai bentuk. Ada yang rantai terbuka ada juga rantai tertutup (melingkar).
1. Rantai Terbuka
Jika sobat punya 2 buah metana molekul metana (CH4) maka sobat bisa menggabungkan kedua molekul tersebut dengan mengganti satu atom H dengan atom C pada molekul yang lain.
Bentuk rantai terbuka yang disebabkan kekhasan atom karbon tidak hanya tunggal (rangkap satu) bisa juga membentuk rantai terbuka dengan rangkap dua atau rangkap tiga.
2. Rantai Tertutup (melingkar)
Sifat yang khas dari atom karbon juga bisa menghasilkan ikatan tertutup atau melingkar. Sobat pernah melihat bentuk molekul dari benzena? Benzena adalah senywa hidrokarbon siklis (bentuknya melingkar) dengna rumus kimia C6H6
Kekhasan atom karbon jika dari bentukk fisiknya yaitu strukturnya sangat rapuh. Akan tetapi ketika ia dibakar akan menghasilkan karbon dioksida atau karbon monoksida beserta air. Hasil pembakaran karbon dapat menghasilkan suhu yang sangat tinggi. Di alam ditemukan 3 bentuk karbon yaitu grafit, intan (diamond) dan lamp black. Semua bentuk tersebut berawarna hitam kecuali intan.
LATIHAN SOAL
Berilah tanda silang (x) sesuai dengan jawaban yang benar!
1. Konfigurasi elektron 12C6 adalah…
a. (2 2) c. (2 6) e. (2 8 2)
b. (2 4) d. (2 8)
2. Banyaknya ikatan kovalen yang dapat dibentuk atom C adalah…
a. 5 c. 3 e. 1
b. 4 d. 2
3. Dalam sistem periodik unsur, periode dan golongan unsur 12C6 adalah…
Periode
|
Golongan
| |
a.
|
2
|
IIA
|
b.
|
2
|
IVA
|
c.
|
3
|
IIA
|
d.
|
3
|
IVA
|
e.
|
4
|
IVA
|
4. Diketahui unsur golongan IVA yaitu C, Si, Ge, Sn dan Pb. Unsur yang mempunyai jari-jari terkecil adalah…
a. C c. Ge e. Pb
b. Si d. Sn
5. Hidrokarbon ada yang jenuh dan tidak jenuh. Yang dimaksud ikatan tidak jenuh dalam ikatan antar karbon adalah…
a. Ikatan tunggal d. Ikatan tunggal, rangkap 2 dan 3
b. Ikatan tunggal dan rangkap 2 e. Ikatan rangkap 2 atau 3
c. Ikatan tunggal dan rangkap 3
6. Alasan atom C dapat membentuk molekul yang panjang adalah…
a. Atom C banyak terdapat di alam d. Atom C stabil
b. Atom C dapat berikatan dengan atom C yang lain e. Atom C reaktif
c. Atom C terletak pada periode 2 dan golongan IVA
7. Perhatikan rumus struktur senyawa berikut ini.
8CH3
1CH3 – 2CH – 3C – 4CH2 – 5CH3
6CH3 7CH3
Yang merupakan atom C primer, sekunder dan tersier berturut-turut adalah…
a. 1,2,3 c. 1,4,2 e. 2,3,4
b. 1,3,4 d. 3,4,5
8. Jumlah atom C sekunder pada senyawa berikut adalah…
CH3 – CH2 – CH – CH – CH2 – CH3
CH3 CH3
a. 1 c. 3 e. 5
b. 2 d. 4
9. Perhatikan rumus struktur senyawa di bawah ini.
H CH3 CH3
1CH3 – 2C – 3C – 4C – 5CH3
CH3 H CH3
Atom C kuarterner terdapat pada nomor…
a. 1 c. 3 e. 5
b. 2 d.4
10. Pernyataan yang benar tentang senyawa organik adalah…
a. Ada yang berikatan ion dan ada yang kovalen
b. Tidak tahan terhadap pemanasan
c. Tahan terhadap pemanasan
d. Titik didih dan titik leleh tinggi
e. Umumnya larut dalam air
11. Bagaimana rumus struktur dari ikatan rangkap tiga berikut C3H4…
a. H – C ≡ C – CH3 d. C ≡ C – CH4
b. CH2 - CH≡ CH e. CH2 ≡ C – CH2
c. C ≡ CH2 – CH2
12. Sampel organik dipanaskan menghasilkan gas yang dapat mengeruhkan air kapur. Informasi ini menunjukkan bahwa sampel organik itu mngandung unsur…
a. Hidrogen d. Belerang
b. Oksigen e. Nitrogen
c. Karbon
13. Gas yang dihasilkan dari pembakaran sampel organik yang jika diuji dengan kertas kobalt akan merubah kertas kobalt dari biru menjadi merah muda. Hal ini berarti sampel organik tersebut mengandung unsur…
a. Hidrogen c. Karbon e. Nitrogen
b. Oksigen d. Belerang
14. Dituliskan beberapa pernyatan sebagai berikut:
1) Mempunyai elektron valensi 6 dan membentuk ikatan kovalen dengan atom hidrogen
2) Mempunyai kemampuan membentuk 4 ikatan kovalen yang kuat
3) Antar atom sejenis tidak dapat membentuk ikatan kovalen rangkap
4) Dapat berikatan dengan atom-atom sejenis membentuk senyawa rantai panjang
Pernyataan yang merupakan ciri khas atom karbon adalah…
- 1 dan 2 c. 2 dan 3 e. 3 dan 4
- 1 dan 3 d. 2 dan 4
15. Apa yang menyebabkan runtuhnya teori “vis vitalis” yang menyatakan bahwa senyawa-senyawa organik hanya dapat dibuat di dalam tubuh makhluk hidup?
a. Kall Wilhelm yang berhasil membuat perbedaan senyawa organik dan anorganik
b. J.J Berzelius yang berhasil menganalisis bahwa senyawa organik mengandung unsur karbon
c. J.J Berzelius yang berhasil mensintesis urea dari ammonium sianat
d. F. Wohler yang berhasil menganalisis bahwa senyawa organik mengandung unsur karbon
e. F. Wohler yang berhasil mensintesis urea dari ammonium sianat
DAFTAR PUSTAKA
Ø Friederich Wohler (1800 – 1882)
murid Berzelius berhasil menumbangkan teori sebelumnya, setelah dia berhasil menyintesis
senyawa organik.
Ø 1807, Jons
Jacob Berzelius (1779 – 1848)
menyatakan teori vis vitalis,
yaitu bahwa senyawa-senyawa organik hanya dapat dibuat di dalam tubuh makhluk
hidup dengan bantuan daya hidup (vis
vitalis),sehingga menurutnya tidak mungkin senyawa organic
Ø Pada tahun 1780, seorang bernama Karl Wilhelm Scheele (1742 – 1786)
http://febbykirihio27.blogspost.com/
